


БНБ
"НТС" (48014)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Газ
Иллюстрация "Газ" в НТС
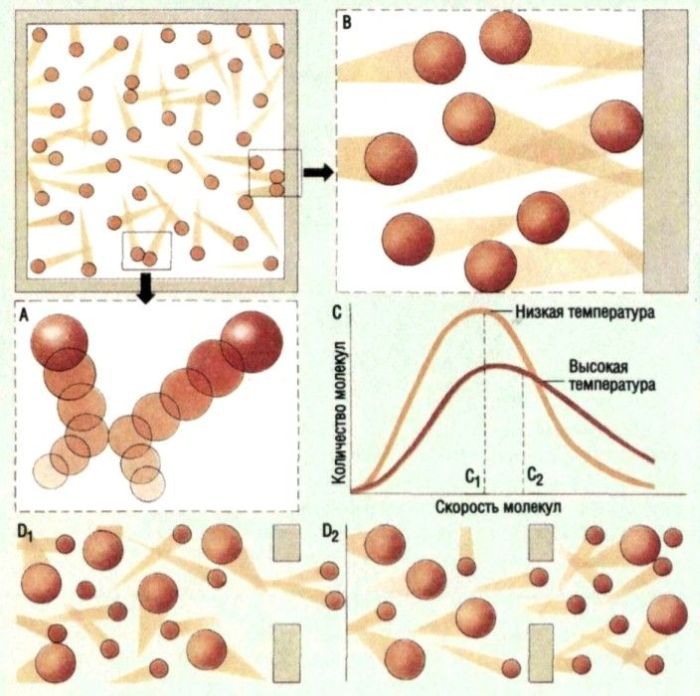
>> Вернуться к статье Газ в НТС >>
| "НТС" >> "Г" >> "ГА" >> "ГАЗ" |
Картинка "Газ" в НТС была показана 3356 раз
| Коптим скумбрию в коробке |
| Пицца в чугунной сковородке |
TOP 15
- Прямое действие конституции
- Конституционный контроль
- Публичное право
- Антимонопольное законодательство
- Германское гражданское уложение
- Декларация прав человека и гражданина 1789 г.
- Предупреждение преступности
- Конституция
- Основы конституционного строя
- Хаммурапи законы
- Международные межправительственные организации
- Ману законы
- Закон
- Исполнение обязательств
- Конституционализм